Изомерия интеллект карта: Oh no - something went wrong!
ЕГЭ по химии. Углеводороды. Алканы. – StudyWay
В ЕЭ по химии начиная с 11 задания начинаются вопросы по органической химии. Ваша задача очень хорошо изучить во-первых изомерию и номенклатуру, а во-вторых характерные химические реакции органических соединений.
Определенная часть органических соединений имеют в своем составе только углерод и водород, поэтому называются углеводородами. Различают ароматические и алифатические углеводороды.
Алифатичексие углеводороды включают следующие классы: алканы, циклоалканы, алкены, алкадиены, алкины.
Начнем наше изучение углеводородов с алканов
Второе название алканов – предельные, насыщенные углеводороды из-за того, что все валентности углерода заняты атомами водорода. Самым простым представителем класса является метан. Он стоит первым в гомологическом ряду, имеет формулу СН4, каждый следующий углеводород в ряду алканов отличатся от своего предшественника на одну СН2 группу. Общая формула гомологического ряда алканов Cnh3n+2.
Строение алканов
Мы с вами уже разобрали в предыдущих статьях что такое sp3-гибридизация, именно в этом состоянии находятся атомы углерода в алканах. Атом углерода образует четыре сигма-связи С-С и С-Н, углы равны 109,5 градусов (вспоминайте про тераэдр). Сигма-связь у нас образуется за счет перекрывания гибридных орбиталей с другими гибридными орбиталями атомов других элементов. При этом оно происходит так, что область максимальной электронной плотности локализуется на прямой, соединяющей ядра атомов. Этот тип перекрывания признан самым эффективным.
Изомерия
Углеродная цепь алканов может принимать самые необычные геометрические формы с учетом сохранения длины связи и углов. Эти положения именуются конформерами. Основной вид изомерии предельных углеводородов – изомерия углеводородного скелета. К примеру изомеры бутан: сам бутан и 2-метилпропан.
Если у молекулы алкана отнять один атом водорода, то получим углеводородный радикал, который имеет одну свободную валентность. Есть такие радикалы, как пропил, метил, этил и так далее.
Есть такие радикалы, как пропил, метил, этил и так далее.
Номенклатура алканов.
Наименования метан, этан, пропан, бутан, пентан применяется для предельных углеводородов, которые содержат один, два, три, четыре и пять атомов углерода в своей цепи. Наименования алканов, кроме первых четырех членов гомологического ряда строится на основе греческого названия, указывающего на число атомов углерода в углеводороде, с добавлением окончания –ан. Например, пентан, в случае пяти атомов, гексан для шести атомов, гептан для семи атомов, октан для восьми и так далее.
Дял успешной сдачи ЕГЭ по химии необходимо запомнить, как минимум названия первых десяти алканов, алкенов, алкинов, спиртов, альдегидов, кетонов, карбоновых кислот. Запомнить достаточно легко будет. Сравните, например,: пентан, пентен, пентин. Это у нас преведен алкан, алкен и алкин.
Однако, каждый алкан может иметь ряд изомерных структур и для каждо структуры должно быть свое название. Для обозначения изомерных бутанов и пентанов применяют приставки: н-бутан, изобутан; изопентан, неопентан. Однако известны 5 гексанов, 9 гептанов и 75 деканов. Запоминать приставки к каждому изомеру трудновыполнимая задача. Поэтому был разработан систематический метод построения названия изомеров.
Однако известны 5 гексанов, 9 гептанов и 75 деканов. Запоминать приставки к каждому изомеру трудновыполнимая задача. Поэтому был разработан систематический метод построения названия изомеров.
Алкильные группы
В неорганике принято давать названия группам атомов, составляющих определенные структурные единицы в разных молекулах. К примеру, SO32- называют сульфитом. Также и в органике даются названия определенным группам атомов, которые можно встретить в виде структурной единицы в различных молекулах. Допустим, хлорметан именуют хлористым метилом, Группу СН3 называют метилом. С4Н9 – бутил, например, С4Н9ОН – бутиловый спирт и так далее.
Название такой группы состоит из названия соответствующего алкана, в названии которого окончание –ан заменяется на окончание –ил. Общее название таких групп – алкильные. Так как в их составе на один атом водорода меньше, чем в исходном алкане.
Такая номенклатура удобна только для обозначения небольших групп. К примеру, у нас есть 4 бутильных группы, две из которых получены из бутана с разветвленной цепью (изобутана) . Их мы обозначаем как н-(нормальный), втор-(вторичный), изо- и трет-(третичный). Различие между этими изомерами заключается в различных местах присоединения алкильной группы к остальной части молекулы. Для следующих членов ряда число изомерных алкильных групп, которые можно получить из каждого алкана становится настолько огромным, что не представляется возможным дать им всем наименование с помощью различных приставок.
К примеру, у нас есть 4 бутильных группы, две из которых получены из бутана с разветвленной цепью (изобутана) . Их мы обозначаем как н-(нормальный), втор-(вторичный), изо- и трет-(третичный). Различие между этими изомерами заключается в различных местах присоединения алкильной группы к остальной части молекулы. Для следующих членов ряда число изомерных алкильных групп, которые можно получить из каждого алкана становится настолько огромным, что не представляется возможным дать им всем наименование с помощью различных приставок.
Если мы рассматриваем большую группу, то приставка н- используется для обозначения любой алкильной группы, где все углеродные атомы выстроены в прямую цепь и в которой место присоединения расположено на концевом атоме углерода. К примеру, н-гексилхлорид.
Приставка изо- используется для определения алкильной группы ( с шестью атомами углерода либо меньше), имеющей одно разветвление на втором с конца атоме углерода и место присоединения располагается на противоположном конце цепи. К примеру, изогексилхлорид. При разветвлении или расположении места присоединения в любом другом положении такое название мы уже не используем.
К примеру, изогексилхлорид. При разветвлении или расположении места присоединения в любом другом положении такое название мы уже не используем.
Мы с вами познакомились с наименованиями некоторого числа алкильных групп и можем вернуться к первопричинам проблемы в названиях насыщенных углеводородов.
Тривиальные наименования в алканах
Мы в предыдущих статьях уже давали определения тривиальной номенклатуре. Давайте теперь спроецируем это на конкретно взятый класс органической химии.
Приставки н-. изо-, нео- разделяют разные бутаны и пентаны, но высшие алканы (начиная с гексана) они не смогут корректно отразить. Потребуется огромное количество приставок. Единственная приставка, которая останется это н-. Обозначает прямую углеродную цепь сколь угодно большого количества атомов углерода.
Изоалканом называют соединение с максимальным количеством углеродных атомов не более шести. При этом все эти атомы за исключением одного образуют прямую цепь, а один атом углерода присоединен ко второму от конца углеродному атому цепи.
Номенклатура IUPAC
Правила наименования соединений согласно IUPAC следующие:
- За основу выбираем самую длинную цепь атомов углерода и считаем, что соединение получается из этой структуры при замене атомов водорода на любые алкильные группы, которые возможны.
- В случае необходимости указывается номер атома углерода, к которому происходит присоединение алкильной группы
- Главную углеродную цепь обозначаем арабскими цифрами таким образом, чтобы цифры, указывающие положение боковых цепей, были наименьшими.
- Если одна и та же алкильная группа встречается в соединении несколько раз, то перед ней добавляется приставка ди-, три-, тетра- и так далее в зависимости от числа алкильных групп. А цифрами обозначают положение каждой группы.
- Если имеем несколько разных алкильных групп, то перечисляем их в порядке возрастания величины, либо в алфавитном порядке.
Виды углеродных и водородных атомов.
Принята классификация атомов углерода с точки зрения числа связанных с ним других атомов углерода. Например, первичный атом углерода связан только с одним атомом углерода, в то время как вторичный уже с двумя другими углеродными атомами, ну а третичный – с тремя.
Такую же классификацию имеют и водородные атомы Аналогично углеродным атомам водородные определяют и называют первичными, вторичными и третичными.
Подобные обозначения применимы при рассмотрении реакционных способностей различных соединений алканов, а также при рассмотрении механизмов реакции.
Физические свойства алканов
Температуры плавления/кипения алканов возрастают с ростом числа атомов в углеродной цепи. Это поясняется тем, что данные процессы требуют преодоления межмолекулярных сил в жидком и твердом агрегатном состоянии. Межмолекулярные силы растут пропорционально росту размеров молекул и как результат происходи увеличения температур кипения и плавления. Температура кипения увеличивается в среднем на 20-30 градусов при увеличении цепи на один атом углерода.
Первые четыре алкана из гомологического ряда представляю собой газы, следующие 13 алканов – жидкости, а высшие алканы – твердые вещества.
Все алканы растворимы в неполярных растворителях, нерастворимы в воде и прочих полярных растворителях. Все представители класса легче воды.
Бюджетное образовательное учреждение дополнительного образования города Омска «Детский Эколого-биологический Центр»
18 Ноя 2021, Комментариев нет
Ссылка: https://vk.com/omskdebc?w=wall-216938459_67
Читать полностью…
23 Июн 2023, Комментариев нет
В преддверии Дня молодежи в Правительстве Омской области состоялось торжественное награждение лауреатов молодежной премии Губернатора Омской области.
Заслуженные награды лауреатам вручил глава Омской области Виталий Хоценко.
Согласно распоряжению Губернатора от 16 июня 2023 года № 71-р премия присвоена педагогу-организатору нашего учреждения Татьяне Ряполовой.
Этой премией поощряются специалисты, которые принимают активное участие в процессе реализации молодежной политики на территории региона и в прошлом году смогли добиться высоких результатов и реализовать актуальные для молодежи проекты.
Читать полностью…
21 Июн 2023, Комментариев нет
Награждение участников муниципального этапа ежегодного Всероссийского (международного) фестиваля «Праздник Эколят – Молодых защитников Природы, состоится в БОУ ДО г. Омска «Детский Экоцентр» ( г. Омск, ул. Маршала Жукова, 109) с 13 июня – 20 июня 2023 года.
Читать полностью…
08 Июн 2023, Комментариев нет
Впереди жаркое лето и период каникул. Не теряйте время сейчас, чтобы не расстраиваться осенью.
Зайдите в личный кабинет АИС «Навигатор дополнительного образования Омской области».
Здесь всё готово к новому 2023-2024 учебному году. Открыта запись на программы, настроено расписание, созданы новые группы.
Найдите интересную программу для вашего ребенка, подайте заявку, и уже с первого сентября он будет заниматься любимым делом и получать знания.
Добро пожаловать в мир дополнительного образования!
Сохраните летние дни беззаботными!
Читать полностью…
07 Июн 2023, Комментариев нет
5 июня 2023 года на территории БОУ ДО г. Омска «Детский ЭкоЦентр» прошел Всероссийский экологический детский фестиваль «Праздник Эколят – Молодых защитников Природы». Участниками стали 80 ребят из образовательных организаций города Омска:
Омска «Детский ЭкоЦентр» прошел Всероссийский экологический детский фестиваль «Праздник Эколят – Молодых защитников Природы». Участниками стали 80 ребят из образовательных организаций города Омска:
Читать полностью…
06 Июн 2023, Комментариев нет
26 мая 2023 года в БОУ ДО г. Омска «Детский ЭкоЦентр» состоялся творческий отчёт педагогического работника Кристины Николаевны Мельниченко.
Читать полностью…
01 Июн 2023, Комментариев нет
На базе БОУ ДО г. Омска «Детский ЭкоЦентр» в рамках федерального и регионального проекта «Успех каждого ребенка» для обучающихся 11-18 лет открывается набор на дополнительную общеобразовательную программу естественнонаучной направленности «Исследовательская лаборатория «Микрокосмос». Цель программы: изучение микромира с помощью микроскопов разного класса.
Читать полностью…
30 мая 2023, Комментариев нет
Дополнительное образование существует и развивается в России с начала XX века.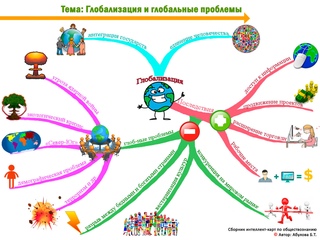 Мы уже привыкли, что есть бесплатные кружки, при желании можно записаться на платные. С 1 сентября 2019 года были введены сертификаты персонифицированного финансирования. За эти несколько лет многие родители и дети смогли воспользоваться ими для оплаты обучения в кружках дополнительного образования. В 2023 году сертификат персфинансирования изменился и вырос в социальный сертификат. Давайте рассмотрим его поподробнее.
Мы уже привыкли, что есть бесплатные кружки, при желании можно записаться на платные. С 1 сентября 2019 года были введены сертификаты персонифицированного финансирования. За эти несколько лет многие родители и дети смогли воспользоваться ими для оплаты обучения в кружках дополнительного образования. В 2023 году сертификат персфинансирования изменился и вырос в социальный сертификат. Давайте рассмотрим его поподробнее.
Читать полностью…
29 мая 2023, Комментариев нет
22 мая 2023 года на базе БОУ ДО г. Омска «Детский ЭкоЦентр» состоялся Всероссийский флешмоб «ЭкоМарш». Флешмоб проводился в целях повышения уровня информированности населения об экологических проблемах особо охраняемых природных территорий. Участниками флешмоба стали 78 учащихся из образовательных организаций города Омска:
Читать полностью…
23 мая 2023, Комментариев нет
«Учись! Развивайся! Побеждай!» под таким девизом 17 мая 2023 года в рамках реализации Целевой модели «Наставничество» состоялся педагогический КВИЗ. В ходе интеллектуальной игры две команды педагогов проверяли свои знания в области педагогики и истории наставничества. Командный дух, азарт, соревновательность, логические вопросы создали доброжелательную атмосферу, позволили педагогам с пользой и весело провести время в компании единомышленников! В итоге с небольшим отрывом победила команда с шуточным названием «Шоколадки».
В ходе интеллектуальной игры две команды педагогов проверяли свои знания в области педагогики и истории наставничества. Командный дух, азарт, соревновательность, логические вопросы создали доброжелательную атмосферу, позволили педагогам с пользой и весело провести время в компании единомышленников! В итоге с небольшим отрывом победила команда с шуточным названием «Шоколадки».
Читать полностью…
19 мая 2023, Комментариев нет
1. «Драконы дома». Педагог: Кутьмина Жанна Леонидовна. Сроки реализации: 1-30 июня.
2. «Мир животных на английском языке». Педагог: Юрьева Софья Сергеевна. Сроки реализации: 1-30 июня.
3. «Мир птиц». Педагог: Яковлев Константин Александрович. Сроки реализации: 1-30 июня.
4. «Эколидер». Педагог: Князева Наталья Ивановна 1-30 июня
5. «Природа в творчестве». Педагог: Барановская Юлия Семеновна. Сроки реализации: 1-30 июня.
Читать полностью…
19 мая 2023, Комментариев нет
В мае 2023 года на базе БОУ ДО г. Омска «Детский ЭкоЦентр» продолжаются занятия по дополнительной общеобразовательной общеразвивающей программе «Основы 3D-моделирования». Укомплектовано 5 групп, зачислено 50 обучающихся.
Омска «Детский ЭкоЦентр» продолжаются занятия по дополнительной общеобразовательной общеразвивающей программе «Основы 3D-моделирования». Укомплектовано 5 групп, зачислено 50 обучающихся.
Читать полностью…
17 мая 2023, Комментариев нет
Флешмоб проводится в целях повышения уровня информированности населения об экологических проблемах особо охраняемых природных территорий.
Участники самостоятельно выбирают формат проведения флешмоба (танцевальный, арт-моб, моб-игра).
Заявки на участие принимаются до 19 мая 2023 года (включительно)
по электронной почте [email protected].
Проведение Флешмоба планируется 22 мая 2023 года
в 16.00 часов местного времени во всех регионах Российской Федерации.
Читать полностью…
16 мая 2023, Комментариев нет
До 25 мая 2023 года ведется приём заявок на муниципальный этап ежегодного Всероссийского (международного) фестиваля «Праздник Эколят – молодых защитников природы».
Читать полностью…
15 мая 2023, Комментариев нет
Изомерия | Карта разума
Мы обнаружили, что в вашем браузере отключен Javascript. Динамический характер нашего сайта означает, что для правильной работы необходимо включить Javascript. Пожалуйста, ознакомьтесь с нашими условиями для получения дополнительной информации.
Далее
Копирование и редактирование
1207200
Описание
Химия (Органическая химия) Интеллектуальная карта по изомерии, созданная linpubotwheeds 28.08.2014. Теги не указаны- органическая химия
- изомерия
- хкдсе
- химия
- органическая химия
Создано linpubotwheeds почти 9 лет назад | ||
- Структурная изомерия
- цепная изомерия
- одинаковые функциональные гп
- структурные изомеры, отличающиеся длиной основной углеродной цепи
- одинаковые функциональные гп
- Позиционная изомерия
- различаются только положением функциональной группы
- одинаковые функциональные гп
- различаются только положением функциональной группы
- Изомерия функциональных групп
- принадлежит к разным гомологическим рядам
- принадлежит к разным гомологическим рядам
- цепная изомерия
- Стереоизомерия
- цис-транс изомерия
- при наличии двойной связи C=C вращение ограничено
- CIS-
- та же сторона
- имеет чистый дипольный момент
- немного более полярная молекула
- более высокая температура кипения
- немного более полярная молекула
- та же сторона
- Транс-
- Противоположная сторона
- без дипольного момента
- неполярный
- более низкая точка кипения
- неполярный
- Противоположная сторона
- при наличии двойной связи C=C вращение ограничено
- энантиомерность
- изображение не накладывается
- изображение не накладывается
- средний углерод: хиральный* углерод
- сходные физические свойства
- различное взаимодействие с поляризованным светом
- плоскость поляризованного света вращается
- можно измерить с помощью поляриметра 90 055
- |+х|=|- x|: та же степень вращения
- плоскость поляризованного света вращается
- цис-транс изомерия
Аналог
Органическая химия
Элла ВольфХимия A Level Unit 1 – Органическая химия
charlottehydeA2 Органическая химия – реакции
900 14 yannycollins Полимеризация.
Химия 6 Извлечение растительного масла GCSE AQA
Хлоя РобертсСырые масла и другие викторины
Дейл ДжорджКарбоновые кислоты 900 03 Кэсси Рэдфорд
Вода и органические макромолекулы
Selam HКарбоновые кислоты и их производные Тест
nicola.batty100Электролиз
lisawinkler10Кислоты и Базы
silviaod119Просмотр библиотеки
Органические механизмы
Органические механизмы[email protected] Мы пытаемся помочь вам изучать химию онлайн.
Дом ВИДЕО Редакция ментальные карты
1. Электрофильное присоединение — Этен и Hbr (карта ассоциаций 1)
2. Электрофильное присоединение — Этен и бром (карта 2)
3. Электрофильное присоединение — Пропен и Hbr (карта 3)
4. Электрофильная добавка — пропен и с. Серная кислота (карта связей 4)
5. Электрофильное присоединение — гидратация этилена (карта связей 5)
Электрофильное присоединение — гидратация этилена (карта связей 5)
6. Sn2 — бромэтан и водный раствор KOH (карта связей 6)
7. Sn2 — бромэтан и спирт KOH (мин. 7)
8. Sn2 — бромэтан и спирт аммиака (диаграмма связей 8)
9. Sn1 — третичный галогеналкан и водный раствор КОН (карта связей 9)
10. Нуклеофильные добавки — пропанон и HCN (диаграмма связей 10)
11. Удаление нуклеофильных добавок — Ch4COCl и вода (карта связей 11)
12. Удаление нуклеофильных добавок — Ch4COCl и этанол (карта связей 12)
13. Удаление нуклеофильных добавок — Ch4COCl и аммиак (карта связей 13)
Ch4COCl и амин ( ментальная карта 14)
15. Устранение нуклеофильных добавок — Ch4COOCh4 и вода (диаграмма связей 15)
16. Устранение нуклеофильных добавок — Ch4COOCh4 и этанол (диаграмма связей 16)
17)
18. Нуклеофильные Аддитивное удаление — Ch4COOCh4 и амин (диаграмма связей 18)
19. Мононитрование бензола (карта связей 19)
20. Монохлорирование бензола (карта связей 20)
Монохлорирование бензола (карта связей 20)
21. Алкилирование по Фриделю-Крафту (карта связей 21)
22. Ацилирование по Фриделю-Крафту (карта связей 22)
23. Устранение — бромэтан и гидроксид KOH (карта 23)
24. Удаление — 2-бромбутан и гидроксид KOH (карта 24)
25 Свободнорадикальное замещение — Метан и хлор (ультрафиолетовое излучение) (карта 25)
26. Истощение озонового слоя (карта 26)
Цели этого веб-сайта
Средняя химия Высшая химия
Периодическая таблица Элементы, соединения и смеси Атомы и связь Химические формулы и уравнения Относительные атомные и молекулярные массы Расчеты в химии Частота реакций Энергетика Неорганическая химия Органическая химия Кислоты, основания и соли Жесткая вода Электролиз Разное: вопросы и ответы
История Периодической таблицы Периодичность
Даты открытия элементов Доберейнер Ньюлендс Менделеев
Элементы Соединения Смеси
Имена Характеристики
Методы разделения смесей Магнит с Fe и S Фильтрация Центрифугирование Хроматография1 Простая перегонка Фракционная перегонка Фракция масла Делительная воронка Разделение сахара и соли
Хроматография2
Практическое видео
Атомная структура Ионная связь Ковалентная связь Металлическое соединение Вопросы и ответы
Электронная конфигурация
LiF NaF КФ MgF2 CaF2 AlF3
LiCl Li2O Li2S Li3N Li3P
NaCl Na2O Na2S Na3N Na3P
KCl К2О К2С К3Н К3П
MgCl2 MgO MgS Mg3N2 Mg3P2
CaCl2 СаО CaS Ca3N2 Ca3P2
AlCl3 Al2O3 Ал2С3 АлN АлП
Водород Фтор хлор Кислород Азот Хлористый водород Вода Сероводород Метан аммиак Углекислый газ Этен Простые ковалентные структуры Гигантские ковалентные структуры
метан йод СО2 Лед
графит Алмаз
Структура металла Податливый и пластичный Электрическая проводимость Нагрев металла
Балансировка химических формул Уравнения балансировки
Схема масс-спектрометра Относительная молекулярная масса Эмпирические формулы
Относительная атомная масса
RMM Excel Cruncher RMM: сульфат аммония РММ: карбонат кальция
Эмпирические формулы
Расчет реактивной массы Реагирование на решения Реагирующие газы Титрование Газовые законы и расчеты Вопросы и ответы
Синтез Реакция Реакция разложения Вода кристаллизации Термитная реакция Кислотно-карбонатная реакция Вулканическая реакция Прикладные вопросы Реагирующая масса и экономика атома Электронная таблица Преобразование молей в другие единицы измерения и из них
Вопросы и ответы
1 и 2 Введение 3 и 4 5 и 6 7 и 8 9 и 10 11 и 12 13 и 14 15 и 16
HCl и NaOH Ch4COOH и NaOH h3SO4 и Nh5OH Кривые титрования
Сильная кислота с сильной щелочью Сильная кислота со слабой щелочью Слабая кислота с сильной щелочью Слабая кислота со слабой щелочью
Экзаменационные вопросы Концентрация Температура Площадь поверхности Катализатор
Экзотермические реакции Эндотермические реакции
Металлы и их соединения Неметаллы и их соединения
Серия реактивности
Группа 1.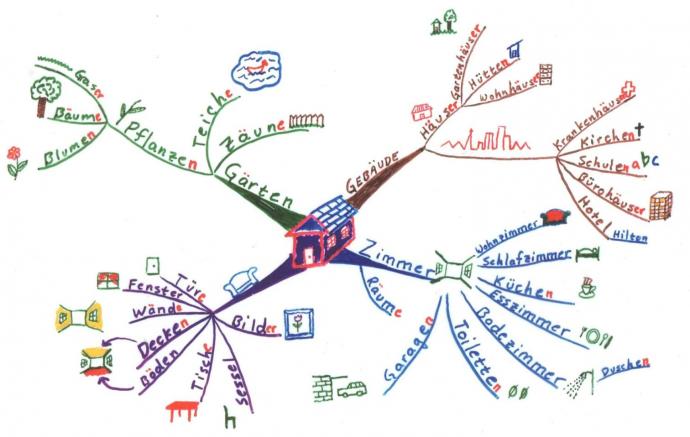 Щелочные металлы
Группа 2. Щелочноземельные металлы
Алюминий
Цинк
Железо
Вести
Медь
Тесты для катионов
Вопросы и ответы
Щелочные металлы
Группа 2. Щелочноземельные металлы
Алюминий
Цинк
Железо
Вести
Медь
Тесты для катионов
Вопросы и ответы
Реакции металлов Реакция смещения Термическое разложение
Калий натрий Литий Кальций Магний с холодной водой Металлы с кислотой
Магний с паром
магний — медь цинк — медь железо-медь магний — медь Термит – Алюминий – Железо
Цикл карбоната кальция
С гидроксидом натрия С аммиаком
Получение водорода. Кислородная подготовка
Углекислый газ
Азот и аммиак
Сера, ее оксиды и серная кислота
Группа 7. Галогены и галогениды
Группа 8. Благородные газы
Вопросы и ответы
Кислородная подготовка
Углекислый газ
Азот и аммиак
Сера, ее оксиды и серная кислота
Группа 7. Галогены и галогениды
Группа 8. Благородные газы
Вопросы и ответы
Свойства сухого льда
Оксиды серы
С нитратом серебра С AgNO3 и Nh4 Реакции смещения Подготовка хлора Подготовка HCl
Введение Углеводороды. Спирт этиловый Этановая кислота Эфиры. Этилэтаноат Конденсационные полимеры Органические оценки Вопросы и ответы Вопросы и Ответы
Что такое гомологичный ряд Фракционная перегонка нефти Крекинг углеводородов
Алканы Алкены
Структуры формул имен Горение Расширенный – метан и хлор
Тест на бромную воду
Кислоты, основания и соли
Временная жесткость Постоянная твердость Удаление жесткости Преимущества недостатки Вопросы и ответы
Стиральная сода Ионный обмен Простая дистилляция
Расплавленные соли Растворы солей Промышленные приложения Материаловедение
Бромид свинца (II) хлорид лития
Бромид свинца (II): видео
Хлорид лития: видео
Вода (с серной кислотой) Рассол — концентрированный хлорид натрия Сульфат меди (II)
Вода (с серной кислотой): Видео
Рассол – концентрированный хлорид натрия – видео
Сульфат меди (II): видео
Камера Зала Эруля Рафинирование блистерной меди
Старое видео
Определение терминов Композитные материалы Керамика
Атомная теория Склеивание и структуры Формы молекул (теория ВСЕПР) Межмолекулярные силы Физическая химия Неорганическая химия Органическая химия Гомологическая серия Окислительно-восстановительная химия Аналитическая химия Электрохимия: цинк/медь Химия окружающей среды
Принцип наращивания (Aufbau) Спектр излучения водорода Спектры пламени Энергия в фотоне света Вопросы и ответы Энергия ионизации
Вопросы и ответы
Тенденции в 1-й энергии ионизации Последовательные энергии ионизации
Ионная связь Ковалентная связь Металлическое соединение
Ионные структуры
Ковалентные структуры
Простой ковалентный Гигантский ковалентный
силы Ван-дер-Ваальса Диполь – дипольные связи Водородные связи Простые ковалентные вещества Гигантские ковалентные вещества
Силы Ван-дер-Ваальса: молекулы воды
Диполь-дипольные связи в воде
Водородные связи: жидкая вода Водородные связи: лед Водородные связи: этанол Водородные связи: Этановая кислота Водородные связи: карбонилы и вода
Метан Углекислый газ Сера Йод Азот Жидкая вода Вода как лед Воздух
Сравнение структур CO2 и SiO2
графит Алмаз Кварц (кремнезем)
родинки Кинетика равновесия Термодинамика
Формулы и уравнения Расчет реактивной массы Титрование
Часть 1 Часть 2 Часть 3
Титрования 1 Титрования 2 Титрования 3 Титрования 4
Теория столкновений Распределение Максвелла-Больцмана Влияние температуры Влияние концентрации Влияние площади поверхности Влияние катализатора Расчеты
Выражение скорости Методы мониторинга ставок Нахождение начальной ставки Уравнение скорости Прикладные вопросы
Качественные эффекты Количественные эффекты
Равновесия разделов
Общие химические равновесия
Кислотно-основное равновесие
Буферы: качественные аспекты.
Поиск Kc. Ку. 1 из 3 Поиск Kc. Ку. 2 из 3 Поиск Kc. Ку. 3 из 3 Нахождение Кр. Ку. 1 из 2 Нахождение Кр. Ку. 2 из 2
рН сильной кислоты pH слабых кислот: использование Ka Кислотно-основные теории: основные принципы.
pH слабой кислоты: расчеты, продолжение
Кислотно-основные теории: вопросы и ответы
Буферы: стратегии для выполнения расчетов. Буферы: вопросы и ответы.
термины и определения Калориметрия Циклы Гесса Бонд Энергия Энергия решетки Энтропия Свободная энергия
MASH-реакция реакция НЕЙТРАЛИЗАЦИИ СМЕЩЕНИЕ реакция ГОРЕНИЕ реакция
Нахождение энтальпии образования Нахождение энтальпии сгорания Использование метода формулы Вопросы и ответы по энергетике
Bond Energy: видео
Циклы Рода Габера Энтальпия раствора
Хлорид натрия Хлорид рубидия Кальций фторид Оксид магния Оксид алюминия Гидрид натрия Вопросы и ответы: структурированный Вопросы и ответы: краткий ответ
Общие моменты термины и определения KCl NaCl Объяснение тенденций в группе 2
Группа 2.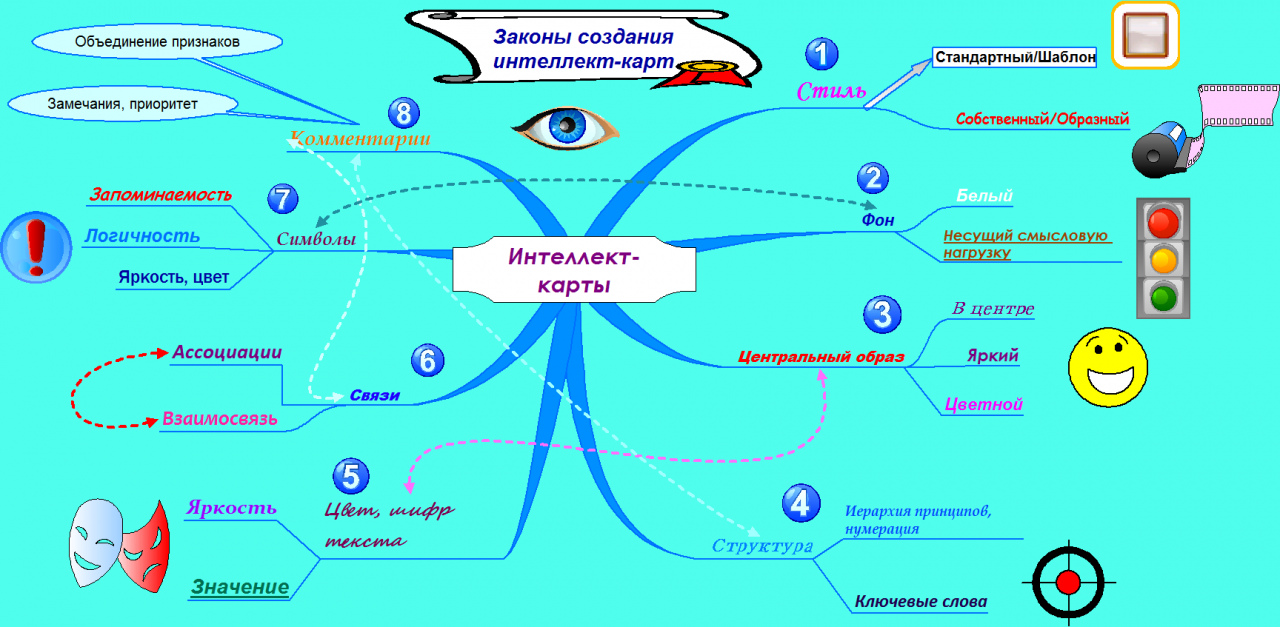 Щелочноземельные металлы
Группа 7. Галогены
Переходные металлы
Комплексы
Комплексы-Другое
Щелочноземельные металлы
Группа 7. Галогены
Переходные металлы
Комплексы
Комплексы-Другое
Галогены: вопросы и ответы
Вопросы и ответы, часть 1 Вопросы и ответы, часть 2 Вопросы и ответы, часть 3
конфигурация и мп тренд происхождение цвета Катализ
определения терминов номенклатура химические свойства окислительно-восстановительные принципы Окислительно-восстановительная химия ванадия Восстановление хрома (III) Равновесие хромат-дихромат Химия хрома (III) Железо (II) и (III) с сильными и слабыми основаниями Химия комплексов кобальта Сульфат меди (II) с NaOH и Nh4 Обратимая замена лиганда на CuCl2
Кристаллы хромовых квасцов, растущие под микроскопом Изготовление кристаллов хромовых квасцов Комплексные ионы: добавление Nh5OH к нитрату хрома (III) Добавление ионов хлорида к водному раствору хлорида кобальта Добавление ионов хлорида к водному сульфату меди (II) Комплексные ионы: добавление NaOH к нитрату хрома (III) Комплексные ионы: обратимая замена лиганда CuCl2 Комплексные ионы: осаждение и окисление гидроксида марганца (II) Комплексные ионы: комплексы хрома Комплексные ионы: комплексы кобальта
Алифатическая химия Ароматическая химия Конденсационные полимеры Органический синтез Органический анализ Практические методы Механизмы реакции
Органические вещества из нефти и угля Цепная изомерия Геометрическая изомерия Оптическая стереоизомерия Алканы Алкены Спирты Алкилгалогениды Альдегиды и кетоны Карбоновые кислоты и производные Сложные эфиры, жиры и масла Этаноилхлорид и этановый ангидрид Амины Нитрилы Пересмотр карбонилов и карбоновых кислот Органические вопросы и ответы
Фракционная перегонка Фракционирование нефти Крекинг парафин
Полное и неполное сгорание
Свободнорадикальное замещение
Органические: межмолекулярные силы
Сигма- и пи-облигации
Номенклатура. Горение
Метан + хлор
Горение
Метан + хлор
Номеклатура, трехмерные структуры и изомеры Тест с бромной водой Электрофильное присоединение — Этен + HBr Электрофильное присоединение — Этен + Бром Электрофильное присоединение — пропен + HBr Дополнительные полимеры HDPE Сигма- и пи-облигации Сигма- и пи-облигации
Реакция с бромом
Механизм: Этен + HBr
Номенклатура, изомерия и п.н. Первичный, вторичный и третичный Спирты от брожения Спирты от гидратации этена Сравнение реакций пропан-1-ола и -2-ола Реакция с PCl5 Реакция с натрием Реакция с SOCl2
Скорость гидролиза хлор-, бром- и йодалканов Подготовить и очистить (основной) Подготовка и очистка (третичный уровень)
Тест с 2,4-ДНП изомеры C6h22O Физические свойства Подготовка Нуклеофильная добавка Реагент Брейди (ДНП) Редукция с Lithal Различать карбонилы Йодоформный тест 2,4-ДНП Реагент Брейди 2,4-ДНП Реагент Брейди
эфиры Номенклатура Физические свойства Кислотность объяснила Подготовка Реакции
переэтерификация подготовка очистить сложные эфиры во фруктах Жиры и масла
Йодное число Значение омыления
Номенклатура и изомерия
Физические свойства
Структуры жиров и масел.