Стиль написания протоколов: Общие правила составления и оформления протокола
Составление и оформление протокола
Новая страница 1Подготовка к оформлению протокола начинается с назначения даты и времени проведения совещания, определения круга вопросов, которые будут рассмотрены на нем. Это решение обычно оформляется повесткой дня, которая при оформлении протокола будет составлять одну из его частей, а до проведения совещания является документом, с помощью которого оповещаются участники заседания. Протокол оформляется на основе записей, которые велись на заседании секретарем вручную или с использованием диктофона.
Протокол оформляется на общем бланке, который обычно включает следующие реквизиты: наименование учреждения (организации, предприятия), вид документа (протокол), места для проставления номера и даты, место для текста протокола, место для заголовка к тексту.
Датой протокола
является день проведения заседания (протоколы, как правило, оформляются после
заседания).
Номером (индексом) протокола является порядковый номер заседания. Нумерация протоколов ведется в пределах календарного года или срока полномочий коллегиального органа.
Заголовок к тесту протокола имеет отличия от оформления этого реквизита в других документах. Как правило, заголовок содержит указание на вид коллегиальной деятельности (совещание, собрание, заседание и др.) и название коллегиального органа в родительном падеже, например: протокол заседания коллегии; собрания трудового коллектива; совещания начальников структурных подразделений.
Текст протокола включает вводную и основную части.
Во вводной части протокола после заголовка
приводятся инициалы и фамилии председателя и секретаря заседания.
Председатель — должностное лицо, проводящее совещание, его должность в протоколе
не указывается; секретарь – лицо, отвечающее за организацию совещания и
документирование его деятельности, т.
С новой строки после слова «Присутствовали» перечисляют инициалы и фамилии постоянных членов коллегиального органа в алфавитном порядке, а также инициалы, фамилии и должности лиц, приглашенных на заседание из других организаций. Список участников совещания секретарь составляет в день его проведения, т.к. список может не совпадать с первоначально намеченным. С составления списка участников заседания начинается оформление протокола.
При оформлении протокола расширенного заседания фамилии участников в протоколе не перечисляются, а указывается цифрой их общее количество. Оно определяется по итогам регистрации. Списки регистрации передаются секретарю собрания и становятся одним из приложений к протоколу. При этом в протоколе указывают:
 (список прилагается).
(список прилагается).Повестка дня включается в вводную часть протокола. Она состоит из перечисления вопросов, которые обсуждаются на заседании, и закрепляет последовательность их обсуждения и фамилии выступающих (докладчиков). Повестка дня заседания, составленная заранее, должна включать оптимальное количество вопросов, которые можно рассмотреть и обсудить на заседании. Ее содержание определяется руководителем, который будет вести заседание. Каждый вопрос повестки дня нумеруется арабскими цифрами и начинается с предлога «О» или «Об» (отвечает на вопрос «О чем?»). По каждому пункту указываются инициалы и фамилия докладчика – должностного лица, который готовил сообщение по данному вопросу.
Текст основной части протокола составляется в соответствии с последовательностью вопросов, установленных повесткой дня.
В основной части текста должно содержаться столько же разделов,
сколько пунктов включено в повестку дня. Разделы нумеруются той же нумерацией,
что и повестка дня. Каждый раздел состоит из трех частей: “СЛУШАЛИ”,
“ВЫСТУПИЛИ”, “ПОСТАНОВИЛИ”, которые печатаются от левого поля. После слова
“СЛУШАЛИ” в тесте протокола излагают записи речи основного докладчика; после
слова “ВЫСТУПИЛИ” – записи высказываний участников обсуждения вопроса; после
слова “ПОСТАНОВИЛИ” – изложение постановляющей части соответствующего пункта
повестки дня. Если по одному вопросу принято несколько решений, они нумеруются
арабскими цифрами, первая цифра показывает номер пункта повестки дня, вторая –
номер принятого решения. Например:
Разделы нумеруются той же нумерацией,
что и повестка дня. Каждый раздел состоит из трех частей: “СЛУШАЛИ”,
“ВЫСТУПИЛИ”, “ПОСТАНОВИЛИ”, которые печатаются от левого поля. После слова
“СЛУШАЛИ” в тесте протокола излагают записи речи основного докладчика; после
слова “ВЫСТУПИЛИ” – записи высказываний участников обсуждения вопроса; после
слова “ПОСТАНОВИЛИ” – изложение постановляющей части соответствующего пункта
повестки дня. Если по одному вопросу принято несколько решений, они нумеруются
арабскими цифрами, первая цифра показывает номер пункта повестки дня, вторая –
номер принятого решения. Например:
|
1.1. Руководителям структурных подразделений к 15.08 2002 подготовить… 1.2. Главному бухгалтеру к 17.08.2002 разработать… |
Обычная практика оформления протокола не
предусматривает фиксацию результатов голосования, однако в ряде протоколов
(например, протоколах общего собрания акционеров) указывается общее количество
лиц, принявших участие в голосовании, и распределение голосов «За», «Против»,
«Воздержались».
Решения, принятые на заседании, доводятся до сведения сотрудников посредством рассылки копий протокола либо выписок постановляющей части. Практикуется также подготовка на основе принятых решений других распорядительных документов, например решения коллегиального органа или приказа руководителя организации.
В тексте протокола каждую фамилию и инициалы выступающего печатают с новой строки в форме именительного падежа. Изложение записи выступления (обычно в форме третьего лица единственного числа) отделяют от фамилии дефисом.
В зависимости от вида заседания и статуса коллегиального органа выбирается форма протокола. Она может быть краткой, полной или стенографической. Формы протокола отличаются друг от друга только полнотой освещения хода заседания, отличий в оформлении они не имеют.
Краткий протокол
– это документ, в котором фиксируются обсуждавшиеся на заседании вопросы,
фамилии докладчиков и принятые решения. Такой протокол, как правило, ведут
только в тех случаях, когда заседание стенографируется или когда заседание носит
оперативный характер. По такому протоколу невозможно представить ход обсуждения
вопроса, высказанные мнения, замечания, процесс выработки распорядительной части
протокола, т.е. управленческого решения.
Такой протокол, как правило, ведут
только в тех случаях, когда заседание стенографируется или когда заседание носит
оперативный характер. По такому протоколу невозможно представить ход обсуждения
вопроса, высказанные мнения, замечания, процесс выработки распорядительной части
протокола, т.е. управленческого решения.
В полном протоколе фиксируются не только обсуждавшиеся вопросы, принятые решения и фамилии выступавших, но и передается содержание докладов и выступлений участников заседания, все высказанные мнения, прозвучавшие вопросы и реплики, замечания, позиции. Полный протокол позволяет документировать подробную картину заседания.
Стенографический протокол составляется на основе
стенографического отчета о заседании (стенограммы) и дословно передает процесс
обсуждения каждого вопроса и выработку решения по нему. После вводной части в
таком протоколе делается запись «Заседание стенографировалось». Стенограмма
является обязательным приложением к протоколу.
Стенограмма
является обязательным приложением к протоколу.
Протоколы составляют на основе рукописных, стенографических или магнитофонных записей, которые ведутся во время заседания. Рукописные записи ведет секретарь, именно от его квалификации зависит качество протокола. В данном случае требуется умение вникнуть в суть обсуждаемых вопросов и суметь их точно записать. Эти записи являются черновыми материалами для дальнейшего оформления протокола. В ряде случаев выступающие на заседании передают секретарю записи (тезисы) своих выступлений, которые затем и включаются в текст протокола. Однако чаще секретарь должен рассчитывать только на свои навыки скорописи, конспектирования и стенографирования. После заседания записи секретаря перепечатываются, редактируются и оформляются как официальный документ. Срок подготовки протокола в настоящее время определен в три дня.
Различия REST и SOAP / Хабр
val6852Время на прочтение 3 мин
Количество просмотров547K
Туториал
Перевод
Автор оригинала: Ranga Karanam
Эта вторая статья в серии постов о разработке REST API:
- Введение в REST API — RESTful веб-сервисы
- Различия REST и SOAP
- Разработка REST API — что такое Contract First (контракт в первую очередь)?
- Разработка REST API — что такое Code First (код в первую очередь)?
- REST API — Что такое HATEOAS?
- Рекомендации по REST API — примеры проектирования веб-сервисов на Java и Spring
В этой статье рассматриваются некоторые аспекты основных различий между REST и SOAP.
Упс… на самом деле, сравнивать их немного похоже на сравнение яблок с апельсинами, поскольку SOAP — это формат протокола, основанный на XML, тогда как REST — это архитектурный подход.
Вы изучите
- Что такое REST?
- Что такое SOAP?
- Чем отличаются REST и SOAP?
REST и SOAP
REST и SOAP на самом деле не сопоставимы. REST — это архитектурный стиль. SOAP — это формат обмена сообщениями. Давайте сравним популярные реализации стилей REST и SOAP.
- Пример реализации RESTful: JSON через HTTP
- Пример реализации SOAP: XML поверх SOAP через HTTP
На верхнем уровне SOAP ограничивает структуры ваших сообщений, тогда как REST — это архитектурный подход, ориентированный на использование HTTP в качестве транспортного протокола.
- Специфика SOAP — это формат обмена данными. С SOAP это всегда SOAP-XML, который представляет собой XML, включающий:
— Envelope (конверт) – корневой элемент, который определяет сообщение и пространство имен, использованное в документе,
— Header (заголовок) – содержит атрибуты сообщения, например: информация о безопасности или о сетевой маршрутизации,
— Body (тело) – содержит сообщение, которым обмениваются приложения,
— Fault – необязательный элемент, который предоставляет информацию об ошибках, которые произошли при обработке сообщений. И запрос, и ответ должны соответствовать структуре SOAP.
И запрос, и ответ должны соответствовать структуре SOAP. - Специфика REST — использование HTTP в качестве транспортного протокола. Он подразумевает наилучшее использование функций, предоставляемых HTTP — методы запросов, заголовки запросов, ответы, заголовки ответов и т. д.
Формат обмена сообщениями
- В SOAP вы используете формат SOAP XML для запросов и ответов.
- В REST такого фиксированного формата нет. Вы можете обмениваться сообщениями на основе XML, JSON или любого другого удобного формата. JSON является самым популярным среди используемых форматов.
Определения услуг
- SOAP использует WSDL (Web Services Description Language) — язык описания веб-сервисов и доступа к ним, основанный на языке XML.
- REST не имеет стандартного языка определения сервиса. Несмотря на то, что WADL был одним из первых предложенных стандартов, он не очень популярен. Более популярно использование Swagger или Open API.

Транспорт
SOAP не накладывает никаких ограничений на тип транспортного протокола. Вы можете использовать либо Web протокол HTTP, либо MQ.
REST подразумевает наилучшее использование транспортного протокола HTTP
Простота реализации
RESTFful веб-сервисы, как правило, гораздо проще реализовать, чем веб-сервисы на основе SOAP.
- REST обычно использует JSON, который легче анализировать и обрабатывать. В дополнение к этому, REST не требует наличия определения службы для предоставления веб-службы.
- Однако в случае SOAP вам необходимо определить свой сервис с использованием WSDL, и при обработке и анализе сообщений SOAP-XML возникают большие накладные расходы.
По этому вопросу также имеется авторское видео.
Резюме
В этой статье мы подробно рассмотрели различия между REST и SOAP.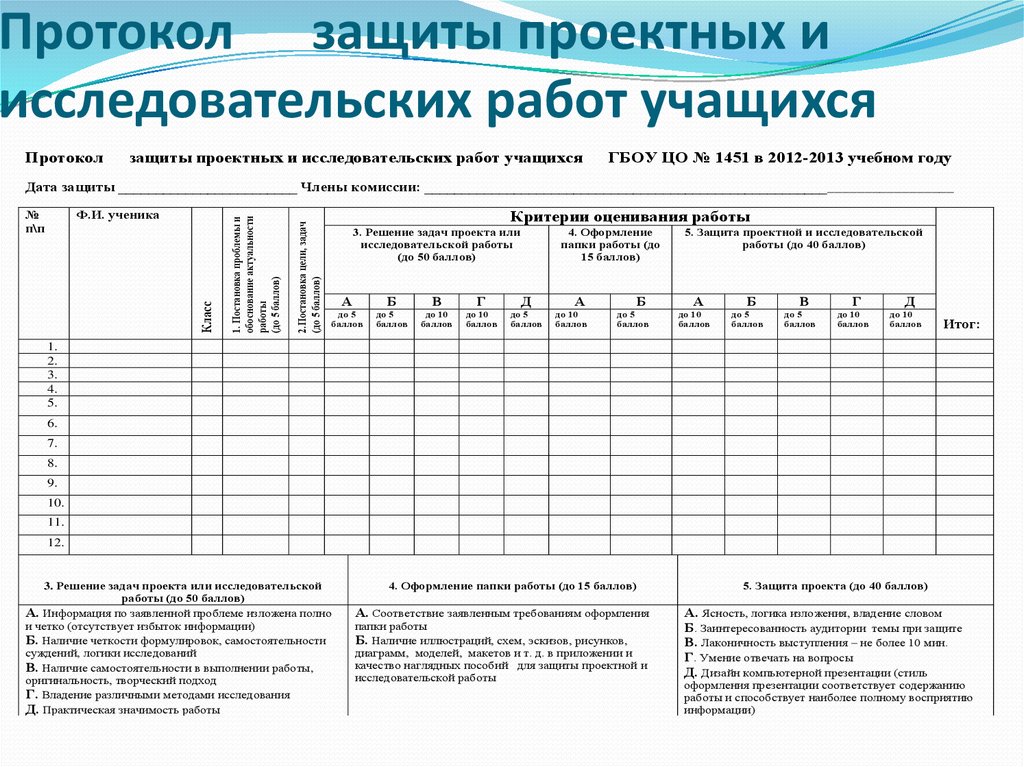
Дополнительное чтение
5 Courses to Learn RESTful Web Services With Java and Spring in 2019
10 API Testing Tips for Beginners (SOAP and REST)
Теги:
- rest
- api
- restful
- web-services
Хабы:
- API
Всего голосов 6: ↑4 и ↓2 +2
Комментарии 7
@val6852
Пользователь
Комментарии Комментарии 7
испытаний | Протокол исследования
Критерии
Статьи протокола исследования, как правило, будут рассматриваться только для предлагаемых или текущих испытаний, которые не завершили набор участников на момент подачи. Испытания рекомендуется предоставлять протоколы исследований задолго до завершения набора, однако иногда мы также рассматриваем протоколы исследований, представленные задолго до последнего пациента/последнего визита. В таких случаях в текст рукописи следует включить ожидаемую дату последнего пациента/последнего визита и объяснение, почему ее нельзя было отправить раньше. Пожалуйста, подтвердите статус вашего исследования при подаче.
В таких случаях в текст рукописи следует включить ожидаемую дату последнего пациента/последнего визита и объяснение, почему ее нельзя было отправить раньше. Пожалуйста, подтвердите статус вашего исследования при подаче.
Испытания также рассматривает протоколы исследований, оценивая аспекты дизайна, проведения или отчетности рандомизированных испытаний. Эти исследования не обязательно должны быть испытаниями и включают такие исследования, как разработка набора основных результатов для использования в испытаниях и оценки процессов, которые проводятся одновременно с испытаниями. Пожалуйста, следуйте соответствующему руководству по отчетности для дизайна исследования и включите соответствующий контрольный список в качестве дополнительного файла.
Все представленные протоколы должны иметь этическое одобрение. Если исследование прошло полное внешнее рецензирование в рамках процесса финансирования, протокол исследования обычно подвергается только редакционному рецензированию со стороны редактора протокола. Протоколы исследований без крупного внешнего финансирования будут проходить полную внешнюю экспертную оценку. Протоколы исследований без этического одобрения, как правило, не рассматриваются. Для обеспечения эффективной работы с вашим протоколом исследования редакторы советуют потенциальным авторам ознакомиться с этой редакционной статьей и узнать, что ожидается при подаче протокола исследования.
Протоколы исследований без крупного внешнего финансирования будут проходить полную внешнюю экспертную оценку. Протоколы исследований без этического одобрения, как правило, не рассматриваются. Для обеспечения эффективной работы с вашим протоколом исследования редакторы советуют потенциальным авторам ознакомиться с этой редакционной статьей и узнать, что ожидается при подаче протокола исследования.
Испытания приветствует публика и терпеливых соавторов. Если в исследовании прямо упоминается участие пациента или общественности в разработке, проведении или распространении исследования, мы предполагаем, что будет по крайней мере один пациент или публичный соавтор.
Обратите внимание: С 1 января 2021 года испытаний больше не будут рассматривать протоколы исследований для пилотных или технико-экономических испытаний для публикации. Вместо этого мы рекомендуем отправлять эти рукописи в наш дочерний журнал 9.0005 Экспериментальные и технико-экономические исследования .
Планы статистического анализа могут быть непосредственно интегрированы в протокол исследования, представляемый для публикации (для несложных РКИ этого может быть достаточно), или включены в качестве дополнительного файла к отправке. Для получения дополнительной информации прочитайте нашу редакционную статью: Проспективные отчеты о планах статистического анализа для рандомизированных контролируемых испытаний. Отдельные планы статистического анализа, представляемые отдельно к протоколу исследования, должны быть представлены в качестве обновления.
Дополнительные файлы
При отправке следующая документация должна быть загружена в качестве дополнительных файлов. Если оригиналы документов не на английском языке, перевод каждого из них на английский язык является обязательным.
- Документ об утверждении этических норм
- Копия оригинальной документации о финансировании
- Заполненный контрольный список SPIRIT (если не использовался шаблон протокола структурированного исследования) или контрольный список для другого соответствующего руководства по отчетности
Руководство SPIRIT
Протоколы исследований, сообщающие о клинических испытаниях, могут быть отформатированы для подачи в Trials двумя способами:
- Следуя указаниям, изложенным в нашем структурированном шаблоне протокола исследования.
 Это предпочтительный вариант, если вы еще не начали писать свою рукопись.
Это предпочтительный вариант, если вы еще не начали писать свою рукопись. - Отправив вместе с рукописью заполненный контрольный список SPIRIT и цифру SPIRIT. Контрольный список SPIRIT можно скачать здесь или заполнить с помощью этого онлайн-инструмента: www.goodreports.org/reporting-checklists/spirit/. Рисунок должен быть включен в основной текст, а контрольный список должен быть предоставлен в виде дополнительного файла. В тексте должны быть ссылки на рисунок и контрольный список. Если какой-либо из этих элементов отсутствует в заявке или если контрольный список SPIRIT неполный (например, отсутствуют номера страниц и строк или краткое объяснение, почему элемент не применим рядом с каждым элементом SPIRIT), рукопись будет возвращена в редакцию. авторы.
Все протоколы клинических испытаний проверяются редактором протоколов, чтобы убедиться, что они соответствуют нашим рекомендациям SPIRIT. Убедитесь, что это руководство тщательно соблюдается, чтобы избежать задержек в процессе рецензирования. Для получения дополнительных советов по соблюдению рекомендаций заявления SPIRIT см.: Контрольный список SPIRIT — уроки из опыта редакторов протоколов SPIRIT.
Для получения дополнительных советов по соблюдению рекомендаций заявления SPIRIT см.: Контрольный список SPIRIT — уроки из опыта редакторов протоколов SPIRIT.
Понятно, что для некоторых протоколов исследований определенные аспекты могут не полностью соответствовать каждому пункту Заявления SPIRIT. В случае использования контрольный список не будет использоваться в качестве инструмента для оценки пригодности рукописей для публикации в Trials , но предназначен для помощи авторам, чтобы ясно, полностью и прозрачно сообщить рецензентам и читателям, что авторы намерены делать. Если пункт неприменим, авторы могут заявить об этом, но также должны добавить краткое объяснение, почему пункт неприменим. Например. Биологические образцы, арт. 33: Неприменимо, образцы не взяты. Если вы просто скажете «Н/Д», рукопись будет возвращена. Аналогичным образом, если используется шаблон структурированного протокола, следуйте инструкциям, оставив все заголовки, идентификаторы и фигурные скобки в указанном порядке, и дайте полный ответ под каждым из них. Полный пример можно найти здесь.
Полный пример можно найти здесь.
Онлайн-шаблон протокола под названием SEPTRE (SPIRIT Electronic Protocol Tool & Resource) также представляет собой веб-вариант для создания, управления и регистрации протоколов с использованием руководства SPIRIT.
На рассмотрении
Авторы, отправляющие на испытания, теперь могут подписаться на услугу под названием На рассмотрении , которая предоставляет услугу допечатной подготовки, то есть статьей можно поделиться со спонсорами и другими лицами в цитируемом путь, пока он находится на рассмотрении. Он также предоставляет авторам по запросу информацию о статусе их рукописи, позволяет им делиться своей работой со спонсорами и другими лицами, а также позволяет их более широкому сообществу комментировать и сотрудничать — все это, пока их рукопись находится на рассмотрении. Полную информацию см. здесь.
Подготовка рукописи
В приведенной ниже информации указаны заголовки разделов, которые следует включить в рукопись, и какая информация должна содержаться в каждом разделе.
Обратите внимание, что ваша рукопись должна включать раздел «Декларации», включая все подзаголовки (дополнительную информацию см. ниже).
Титульный лист должен:
- представлять заголовок, включающий информацию о дизайне исследования, популяции, вмешательствах и, если применимо, аббревиатуру исследования в следующем формате: «___________: протокол исследования для ___________пробный.»
- перечислите полные имена, адреса организаций и адреса электронной почты всех авторов
- , если группа сотрудничества должна быть указана в качестве автора, пожалуйста, укажите название группы в качестве автора. Если вы хотите, чтобы имена отдельных членов Группы были доступны для поиска в их индивидуальных записях PubMed, включите эту информацию в раздел «Благодарности» в соответствии с приведенными ниже инструкциями
- укажите соответствующего автора
Объем аннотации не должен превышать 350 слов. Пожалуйста, сведите к минимуму использование сокращений и не цитируйте ссылки в аннотации. Резюме должно включать следующие отдельные разделы:
Пожалуйста, сведите к минимуму использование сокращений и не цитируйте ссылки в аннотации. Резюме должно включать следующие отдельные разделы:
- Исходная информация: контекст и цель исследования
- Методы: как будет проводиться исследование
- Обсуждение: краткое изложение и возможные последствия
- Пробная регистрация: Если в вашей статье сообщается о результатах медицинского вмешательства с участием людей, она должна быть зарегистрирована в реестре ICRTP ВОЗ. В этом разделе должны быть указаны название реестра, регистрационный номер и дата регистрации. Если он не был зарегистрирован проспективно (до регистрации первого участника), необходимо указать слова «зарегистрирован задним числом». См. наши редакционные правила для получения дополнительной информации о регистрации пробной версии. Если в вашей статье сообщается о результатах научных исследований, и вы зарегистрировали свою работу в реестре Research on Research (RoR), укажите URL-адрес записи реестра.

От трех до десяти ключевых слов, представляющих основное содержание статьи.
В разделе «Справочная информация» следует объяснить предысторию исследования, его цели, краткое изложение существующей литературы и почему это исследование необходимо или его вклад в данную область.
Раздел методов должен включать:
- цель, дизайн и условия исследования
- характеристики участников или описание материалов
- четкое описание всех процессов, вмешательств, сравнений и деталей процесса рандомизации. Как правило, следует использовать общие названия лекарств. Если в исследованиях используются запатентованные торговые марки, в скобках укажите названия торговых марок
- и тип используемого статистического анализа, включая, при необходимости, расчет мощности.
Это должно включать обсуждение любых практических или операционных вопросов, связанных с проведением исследования, а также любых вопросов, не затронутых в других разделах.
Авторы должны сообщить номер и дату версии протокола, дату начала набора и приблизительную дату завершения набора.
Если сокращения используются в тексте, они должны быть определены в тексте при первом использовании, и должен быть предоставлен список сокращений. Пожалуйста, постарайтесь не использовать в тексте слишком много ненужных акронимов и аббревиатур. Если это мешает разборчивости рукописи, редактор может попросить вас удалить их.
Декларации
Все рукописи должны содержать следующие разделы под заголовком «Декларации»:
- Утверждение этики и согласие на участие
- Соревнование для публикации
- . Вклад авторов
- Благодарности
- Информация об авторах (необязательно)
Подробная информация об информации, которая должна быть включена в эти разделы, приведена ниже. Если какой-либо из разделов не имеет отношения к вашей рукописи, включите заголовок и напишите «Не применимо» для этого раздела.
Если какой-либо из разделов не имеет отношения к вашей рукописи, включите заголовок и напишите «Не применимо» для этого раздела.
Этическое одобрение и согласие на участие
Испытания не учитывают протоколы исследований для исследований без этического одобрения. Вы должны будете предоставить копию оригинального документа об этическом утверждении и перевод этого документа на английский язык в качестве дополнительного файла при подаче, который будет сверяться с этой декларацией. Следует указать название комитета по этике, утвердившего исследование, и регистрационный номер комитета (если применимо). Подробная информация о намерениях авторов получить согласие на участие в исследовании от участников (или их родителей или законных опекунов в случае детей до 16 лет) должна быть объявлена. «например. Совет по этике ABC ABC123456. Письменное информированное согласие на участие будет получено от всех участников »
Дополнительная информация
Согласие на публикацию
Пожалуйста, не включайте какие-либо исходные или экспериментальные данные в протокол исследования. Редакция попросит вас удалить это, если оно включено. Если вы включили какие-либо сведения, изображения или видео, относящиеся к отдельному лицу, письменное информированное согласие на публикацию этих сведений должно быть получено от этого лица (или его родителя или законного опекуна в случае детей младше 18 лет) и заявлено в настоящем документе. раздел. Также укажите, готовы ли вы предоставить типовую форму согласия по запросу. Если этот раздел не применим, укажите «Не применимо».
Редакция попросит вас удалить это, если оно включено. Если вы включили какие-либо сведения, изображения или видео, относящиеся к отдельному лицу, письменное информированное согласие на публикацию этих сведений должно быть получено от этого лица (или его родителя или законного опекуна в случае детей младше 18 лет) и заявлено в настоящем документе. раздел. Также укажите, готовы ли вы предоставить типовую форму согласия по запросу. Если этот раздел не применим, укажите «Не применимо».
Дополнительная информация
Наличие данных и материалов
Пожалуйста, не включайте какие-либо базовые или пилотные данные в протокол исследования. Редакция попросит вас удалить это, если оно включено. Укажите, кто будет иметь доступ к окончательному набору данных испытаний, и раскройте контрактные соглашения, которые ограничивают такой доступ для исследователей.
Дополнительная информация
Конкурирующие интересы
Все финансовые и нефинансовые конкурирующие интересы должны быть указаны в этом разделе. Полное объяснение конкурирующих интересов см. в нашей редакционной политике. Если вы не уверены, есть ли у вас или у кого-либо из ваших соавторов конкурирующие интересы, свяжитесь с редакцией. Пожалуйста, используйте инициалы авторов для обозначения конкурирующих интересов каждого автора в этом разделе. Если у вас нет конкурирующих интересов, укажите в этом разделе: «Авторы заявляют об отсутствии конкурирующих интересов».
Полное объяснение конкурирующих интересов см. в нашей редакционной политике. Если вы не уверены, есть ли у вас или у кого-либо из ваших соавторов конкурирующие интересы, свяжитесь с редакцией. Пожалуйста, используйте инициалы авторов для обозначения конкурирующих интересов каждого автора в этом разделе. Если у вас нет конкурирующих интересов, укажите в этом разделе: «Авторы заявляют об отсутствии конкурирующих интересов».
Дополнительная информация
Финансирование
Необходимо указать все источники финансирования исследования. Вы должны будете приложить копию оригинального документа о финансировании и перевод этого документа на английский язык в качестве дополнительного файла при подаче, который будет сверяться с этой декларацией. Роль финансирующей организации в разработке исследования и сборе, анализе и интерпретации данных, а также в написании рукописи должна быть заявлена.
Вклад авторов
Индивидуальный вклад авторов в рукопись должен быть указан в этом разделе. Руководство и критерии авторства можно найти в наших редакционных правилах. Пожалуйста, используйте инициалы для обозначения вклада каждого автора в этом разделе, например: «AB является главным исследователем; она задумала исследование, руководила разработкой предложения и протокола. CD внесла свой вклад в дизайн исследования и разработку предложения. EF был ведущий методист исследования. Все авторы прочитали и одобрили окончательный вариант рукописи». Trials приветствует публику и терпеливых соавторов. Если в исследовании прямо упоминается участие пациента или общественности в разработке, проведении или распространении исследования, мы предполагаем, что будет по крайней мере один пациент или публичный соавтор.
Руководство и критерии авторства можно найти в наших редакционных правилах. Пожалуйста, используйте инициалы для обозначения вклада каждого автора в этом разделе, например: «AB является главным исследователем; она задумала исследование, руководила разработкой предложения и протокола. CD внесла свой вклад в дизайн исследования и разработку предложения. EF был ведущий методист исследования. Все авторы прочитали и одобрили окончательный вариант рукописи». Trials приветствует публику и терпеливых соавторов. Если в исследовании прямо упоминается участие пациента или общественности в разработке, проведении или распространении исследования, мы предполагаем, что будет по крайней мере один пациент или публичный соавтор.
Дополнительная информация
Благодарности
Пожалуйста, отметьте всех, кто внес свой вклад в подготовку статьи, но не соответствует критериям авторства, включая тех, кто предоставил профессиональные письменные услуги или материалы. Авторы должны получить разрешение от всех лиц, упомянутых в разделе «Благодарности». См. наши редакционные правила для полного объяснения благодарностей и критериев авторства. Если вам некого подтвердить, пожалуйста, напишите «Не применимо» в этом разделе.
См. наши редакционные правила для полного объяснения благодарностей и критериев авторства. Если вам некого подтвердить, пожалуйста, напишите «Не применимо» в этом разделе.
Групповое авторство (для рукописей с участием совместной группы): если вы хотите, чтобы имена отдельных членов совместной группы были доступны для поиска в их индивидуальных записях PubMed, убедитесь, что название совместной группы включено в название. странице и в системе отправки, а также включить имена сотрудничающих авторов в качестве последнего абзаца раздела «Благодарности». Пожалуйста, добавляйте авторов в формате Имя, Инициал(ы) отчества (необязательно), Фамилия. Вы можете добавить информацию об учреждении или стране для каждого автора, если хотите, но это должно быть одинаковым для всех авторов. Обратите внимание, что отдельные имена могут отсутствовать в записи PubMed на момент первоначального включения опубликованной статьи в PubMed, поскольку PubMed требуется дополнительное время для кодирования этой информации.
Информация об авторах (необязательно)
Этот раздел является необязательным.
Вы можете использовать этот раздел для включения любой соответствующей информации об авторе (авторах), которая может помочь читателю интерпретировать статью и понять точку зрения автора (авторов). Это может включать сведения о квалификации авторов, нынешних должностях, которые они занимают в учреждениях или обществах, или любую другую соответствующую справочную информацию. Пожалуйста, ссылайтесь на авторов, используя их инициалы. Обратите внимание, что этот раздел не следует использовать для описания каких-либо конкурирующих интересов.
Сноски
Сноски могут использоваться для предоставления дополнительной информации, которая может включать цитирование ссылки, включенной в список литературы. Они не должны состоять исключительно из ссылочной цитаты и никогда не должны включать библиографические детали ссылки. Они также не должны содержать никаких рисунков или таблиц. Сноски к тексту нумеруются последовательно; те, что к таблицам, должны быть обозначены надстрочными буквами верхнего индекса (или звездочками для значений значимости и других статистических данных). В сносках к названию или авторам статьи условные обозначения не даются. Всегда используйте сноски вместо концевых сносок.
В сносках к названию или авторам статьи условные обозначения не даются. Всегда используйте сноски вместо концевых сносок.
Справочные номера
Ниже приведены примеры стиля ссылочного номера Ванкувера.
См. наши редакционные правила для руководства авторов по надлежащей практике цитирования. чем в тексте рукописи. Они должны быть предоставлены полностью, включая название сайта и URL-адрес, а также дату обращения к сайту в следующем формате: База данных биологии опухолей мышей. http://tumor.informatics.jax.org/mtbwi/index.do. По состоянию на 20 мая 2013 г. Если автора или группу авторов можно явно связать с веб-ссылкой, например, для веб-блогов, то они должны быть включены в ссылку.
Пример стиля ссылки:
Статья в журнале
Smith JJ. Мир науки. Am J Sci. 1999;36:234-5.
Статья в журнале (без номеров страниц)
Rohrmann S, Overvad K, Bueno-de-Mesquita HB, Jakobsen MU, Egeberg R, Tjønneland A, et al. Потребление мяса и смертность — результаты Европейского перспективного исследования рака и питания. БМК Медицина. 2013;11:63.
Потребление мяса и смертность — результаты Европейского перспективного исследования рака и питания. БМК Медицина. 2013;11:63.
Статья в журнале DOI
Слифка М.К., Уиттон Дж.Л. Клинические последствия нарушения регуляции продукции цитокинов. Диг Дж Мол Мед. 2000 г.; дои: 10.1007/s8010
086.
Статья в приложении к журналу
Фрумин А.М., Нуссбаум Дж., Эспозито М. Функциональная аспления: демонстрация активности селезенки при сканировании костного мозга. Blood 1979; 59 Приложение 1:26-32.
Глава книги или статья в книге
Wyllie AH, Kerr JFR, Currie AR. Гибель клеток: значение апоптоза. В: Bourne GH, Danielli JF, Jeon KW, редакторы. Международный обзор цитологии. Лондон: Академический; 1980. с. 251-306.
OnlineПервая глава в серии (без обозначения тома, но с DOI)
Saito Y, Hyuga H. Подходы уравнения скорости к усилению энантиомерного избытка и нарушению хиральной симметрии. Top Curr Chem. 2007. Дои: 10.1007/128_2006_108.
2007. Дои: 10.1007/128_2006_108.
Полная книга, авторы
Бленкинсопп А., Пакстон П. Симптомы в аптеке: руководство по лечению распространенных заболеваний. 3-е изд. Оксфорд: Наука Блэквелла; 1998.
Интернет-документ
Доу Дж. Название подчиненного документа. В: Словарь веществ и их эффектов. Королевское химическое общество. 1999. http://www.rsc.org/dose/title подчиненного документа. По состоянию на 15 января 1999 г.
Онлайн-база данных
База знаний Healthwise. Фармакопея США, Роквилл. 1998 г. http://www.healthwise.org. По состоянию на 21 сентября 1998 г.
Дополнительный материал/частная домашняя страница
Доу Дж. Название дополнительного материала. 2000. http://www.privatehomepage.com. По состоянию на 22 февраля 2000 г.
Сайт университета
Доу, Дж.: Название препринта. http://www.uni-heidelberg.de/mydata.html (1999 г.). По состоянию на 25 декабря 1999 г.
FTP-сайт
Доу, Дж. : Trivial HTTP, RFC2169. ftp://ftp.isi.edu/in-notes/rfc2169.txt (1999 г.). По состоянию на 12 ноября 1999 г.
: Trivial HTTP, RFC2169. ftp://ftp.isi.edu/in-notes/rfc2169.txt (1999 г.). По состоянию на 12 ноября 1999 г.
Сайт организации
Международный центр ISSN: Реестр ISSN. http://www.issn.org (2006 г.). По состоянию на 20 февраля 2007 г.
Набор данных с постоянным идентификатором
Чжэн Л-И, Го Х-С, Хе Б, Сун Л-Дж, Пэн Ю, Донг С-С и др. Данные генома сладкого и зернового сорго (Sorghum bicolor). База данных GigaScience. 2011. http://dx.doi.org/10.5524/100012.
Рисунки, таблицы и дополнительные файлы
Информацию о форматировании рисунков, таблиц и дополнительных файлов см. в разделе Общие рекомендации по форматированию.
Отправить рукопись
Отправить рукопись
- Редакционная коллегия
- Услуги по редактированию рукописей
- Инструкции для редакторов
- Инструкция для авторов
- Подпишитесь на оповещения о статьях и новости из этого журнала
Follow
Annual Journal Metrics
Что нужно знать при написании клинического протокола
by Sumudu Narayana
Клинический протокол — это основа исследования, в которой описывается, как будет проводиться исследование, и содержатся все необходимые рекомендации для исследовательской группы.
Написание протокола исследования для клинического испытания — сложный и трудоемкий процесс. Это также может быть немного пугающим поначалу, особенно исходя из более общего опыта биомедицинских наук с ограниченным пониманием клинического мира, как это было у меня.
Все мы совершаем ошибки, но некоторые из них могут быть более утомительными, чем другие. Имея это в виду, вот несколько вещей, которые мне хотелось бы знать до того, как я написал свой первый клинический протокол.
1. Наличие определенного вопроса исследования и основного результатаЧетко сформулированный вопрос исследования и основной результат необходимы для написания клинического протокола. Ваш исследовательский вопрос является самой целью исследования. Это может варьироваться от получения научных знаний в терапевтической области, нуждающейся в инновациях, до проведения важного исследования по тестированию нового лекарства.
Вопросы исследования должны содержать нейтральную формулировку и определять цель и объем исследования. Плохо сформулированный вопрос сразу же заставит вас задуматься.
Плохо сформулированный вопрос сразу же заставит вас задуматься.
Например:
БАД: Для оценки влияния рифаксимина на заболевание печени.
Почему? В вопросе не указаны эффекты рифаксимина, которые оцениваются в исследовании. Точно так же заболевание печени включает в себя широкий спектр состояний и осложнений, и этот исследовательский вопрос не проясняет, что изучается в исследовании.
ЛУЧШЕ: Оценить эффективность рифаксимина в снижении портальной гипертензии у небольшой группы пациентов с компенсированным циррозом печени.
Мера, с помощью которой можно получить ответ на вопрос исследования, называется первичным результатом. Важно иметь один определенный первичный результат и иметь ограниченное количество связанных вторичных результатов. Это связано с тем, что в клинических условиях легко собрать большое количество данных, которые в конечном итоге могут оказаться совершенно ненужными для решения вопроса исследования.
Наличие четких определений предмета исследования помогает избежать сценария «сделай все» и поможет сузить круг методов исследования. Это также помогает избежать получения неточных результатов.
Всегда помните: качество получаемых вами данных является отражением мыслей и усилий, затраченных на разработку исследования .
Совет. При планировании исследования перепроверьте свою тему и связанные с ней темы в реестрах клинических испытаний, чтобы убедиться, что ваш исследовательский вопрос не является зарегистрированным в настоящее время исследованием или уже изучался.
2. Проведение статистического планированияКогда я писал свой первый протокол, я не знал о статистическом планировании. Но вскоре я узнал, насколько важна клиническая статистика при написании протокола.
Очень важно определить, сколько пациентов необходимо для вашего исследования, и это первый этап статистического планирования.
Расчет мощности и оценка размера выборки используются для расчета количества участников, необходимого для ответа на вопрос исследования. Эти расчеты помогают создать соответствующий размер выборки, которую затем можно использовать для выводов обо всей совокупности.
На этом этапе также важно определить свои статистические методы и план анализа данных. Это связано с тем, что иногда тип статистического анализа, который вы планируете использовать в конце исследования, может повлиять на размер выборки, необходимой для исследования. Например, для исследования с использованием непараметрического теста (например, U Манна-Уитни) потребуется больше пациентов, чем для исследования с использованием параметрического теста (например, t-критерия Стьюдента).
Я рекомендую работать с обученным специалистом по биостатистике на ранних этапах разработки протокола, чтобы убедиться, что исследование спланировано должным образом. Это также поможет вам освежить вашу клиническую статистику и даже изучить некоторые новые методы, как это сделал я.
Вам также потребуется доступ к некоторому статистическому программному обеспечению. IBM SPSS широко используется, поскольку он прост в использовании и позволяет проводить широкий спектр статистических анализов, таких как описательный анализ, одномерный и многомерный анализ и прогнозное моделирование. Однако существует ряд альтернатив, включая MATLAB, STATA, SAS и бесплатный пакет с открытым исходным кодом R.
Совет. Для работы в клинических испытаниях вам потребуются базовые статистические знания в следующих областях: описательная статистика , оценка и проверка гипотез, рандомизация и анализ выживаемости. Существует ряд бесплатных онлайн-курсов, которые вы можете пройти, чтобы изучить или освежить свои статистические навыки.
3. Сотрудничайте со своей исследовательской группой и вспомогательным персоналом исследования Установление позитивных и продуктивных отношений с другими членами исследовательской группы и ключевым вспомогательным персоналом принесет много наград. В состав вашей исследовательской группы и вспомогательного персонала могут входить врачи, медсестры, фармацевты (при выдаче лекарств), физиотерапевты и сотрудники лабораторных служб (обработка крови).
В состав вашей исследовательской группы и вспомогательного персонала могут входить врачи, медсестры, фармацевты (при выдаче лекарств), физиотерапевты и сотрудники лабораторных служб (обработка крови).
Как исследователь с базовым научным образованием, мне было сложно углубляться в клинические аспекты ухода за пациентами и исследовательские процедуры. Хорошие рабочие отношения со всеми членами исследовательской группы позволили мне задавать вопросы (их было много для моего первого протокола). Например, мне пришлось расспросить врачей и медсестер в нашей команде об осложнении заболевания печени (тема моего исследования) и связанных с ним процедурах, чтобы понять тему моего клинического проекта.
Не бойтесь задавать вопросы, лучше задать много вопросов и научиться, чем писать что-то не так в протоколе из-за того, что вы не поняли методику или клиническую терминологию. Не менее важно учитывать комментарии вашей исследовательской группы при разработке протокола исследования. Эти отношения также важны при разработке исследования, поскольку они позволяют четко обсудить роли и ожидания каждого члена команды во время исследования.
Эти отношения также важны при разработке исследования, поскольку они позволяют четко обсудить роли и ожидания каждого члена команды во время исследования.
Совет: я рано понял, что все члены исследовательской группы заняты своими основными ролями. Всегда назначайте встречи с членами команды, готовьте список конкретных вопросов, которые у вас есть, и помните об их времени. Это поможет создать хорошую основу для ваших рабочих отношений.
4. Право на участие и методы исследованияНаиболее важной частью протокола исследования является описание процессов исследования и логистики того, как исследование будет завершено.
Протокол должен охватывать темы, которые варьируются от идентификации участников до набора и сбора данных и управления ими.
Руководство CONSORT 2010 — полезный инструмент для планирования исследования. Это международно признанный « минимальный набор рекомендаций для отчетности по рандомизированным испытаниям ». Контрольный список CONSORT 2010 содержит подробный список из 25 пунктов, которые необходимо учитывать при разработке плана исследования и отчетности.
Контрольный список CONSORT 2010 содержит подробный список из 25 пунктов, которые необходимо учитывать при разработке плана исследования и отчетности.
Заявление SPIRIT 2013 — еще один ценный источник. Это была инициатива ведущих экспертов « улучшить полноту и качество протоколов испытаний ». В заявлении содержатся исчерпывающие рекомендации по дизайну испытаний, регистрации испытаний и этическим принципам.
Критерии приемлемости для участия в исследовании имеют решающее значение и должны быть простыми, чтобы максимизировать набор участников исследования. Критерии включения предназначены для определения исследуемой популяции. Критерии исключения дополнительно уточняют исследуемую популяцию и должны включать соответствующие противопоказания.
Как фундаментальный ученый, я нашел этот раздел самым трудным для написания и полагался на свои отношения с другими членами исследовательской группы, чтобы определить критерий. Также рекомендуется включить список оценок исследования и график, когда эти оценки будут происходить в методах исследования. Убедитесь, что это ясно и легко для понимания.
Убедитесь, что это ясно и легко для понимания.
Я считаю эффективным использование таблицы или блок-схемы для описания оценок исследования и расписания.
Постарайтесь, где это возможно, указать, когда будет проводиться оценка и будет ли она проводиться в рамках конкретного исследования или в рамках стандартного лечения. Это уменьшит количество вопросов и комментариев, которые вы получите от совета по этике, а также позволит каждому члену команды узнать, как будет проходить исследование.
Совет: Попросите, чтобы ваш протокол исследования просмотрел кто-то, кто не входит в вашу исследовательскую группу, но имеет базовое понимание темы вашего исследования. Неформальное рецензирование ценно, поскольку оно поможет выявить потенциальные недостатки в дизайне исследования или дополнительные методы исследования, которые можно добавить. Также поищите другие бесплатные системы рецензирования, которые могут быть доступны в вашем институте или регионе. Например, в Австралии у нас есть Национальный научный комитет NHMRC , который дает рекомендации относительно научной ценности и достоверности протокола исследования.
В 1964 году Всемирная медицинская ассоциация разработала Хельсинкскую декларацию как заявление этических принципов медицинских исследований с участием людей. Эти рекомендации составляют основу действующего международного стандарта Международной конференции по гармонизации – надлежащей клинической практике (ICH-GCP).
ICH-GCP — это «Международный этический и научный стандарт качества для разработки, проведения, регистрации и отчетности испытаний, в которых участвуют люди ». Советы по этике и другие регулирующие комитеты соблюдают 13 основных принципов ICH-GCP. Вы можете найти эти рекомендации в Интернете.
Главный исследователь и разработчик протокола несут ответственность за обеспечение того, чтобы их исследование соответствовало этим рекомендациям, а также любому дополнительному местному или национальному законодательству.
В Австралии мне нужно было получить разрешение от Закона о терапевтических товарах для испытаний лекарств и подтвердить, что протоколы соответствуют законодательству штата и федеральному законодательству.
Итак, когда вы разрабатываете протокол, задайте себе некоторые из следующих вопросов:
- Включает ли протокол тестирование нового/неутвержденного препарата или устройства?
- Является ли протокол испытания одобренного лекарственного средства или устройства не по назначению? Или за пределами предполагаемой популяции пациентов?
Если что-то из этого применимо, работайте вместе с исследовательским отделом, чтобы убедиться, что вы соблюдаете соответствующие нормативные стандарты, и обратитесь за советом, если вы не уверены в каком-либо аспекте. Связь с офицером по этике вашего учреждения, безусловно, будет полезна для этого раздела протокола.
Отчетность по безопасности испытаний является одним из основных требований ICH-GCP.
В рамках клинического протокола важно указать, что является нежелательным явлением, о котором следует сообщать, а что нет. Кроме того, следует также уточнить, кто несет ответственность за сообщение о нежелательных явлениях и кому о них следует сообщать. Нежелательное явление — это неожиданный или непреднамеренный симптом или заболевание, которое может быть связано или не быть связано с медицинским лечением или процедурой.
Нежелательное явление — это неожиданный или непреднамеренный симптом или заболевание, которое может быть связано или не быть связано с медицинским лечением или процедурой.
Существуют стандартные рекомендации (например, в Австралии у нас есть государственные Австралийские клинические рекомендации) и шаблоны, такие как Общие терминологические критерии нежелательных явлений (CTCAE), на которые вы можете ссылаться.
В зависимости от типа исследования, которое вы проводите, и участвующих в нем участников может быть целесообразно адаптировать формулировку нежелательных явлений к исследовательскому исследованию, чтобы избежать ненужного завышения показателей.
Совет. Одна вещь, которая помогла мне с отчетами о безопасности, — это создание таблицы потенциальных нежелательных явлений для испытания, которое я разрабатываю. Также полезно вести журнал нежелательных явлений для каждого участника, включенного в исследование, так как это позволяет мне документировать и отслеживать любые события, происходящие во время исследования. Этот журнал должен включать такие сведения, как нежелательное явление, дата начала, степень CTCAE и связь с исследуемым препаратом/процедурой.
Этот журнал должен включать такие сведения, как нежелательное явление, дата начала, степень CTCAE и связь с исследуемым препаратом/процедурой.
Регистрация исследования — это шаг, который следует за разработкой протокола и этической экспертизы, но он необходим до включения любых пациентов в ваше клиническое исследование.
Существует ряд причин, по которым исследование должно быть зарегистрировано в открытом реестре клинических испытаний. К ним относятся предотвращение выборочной отчетности и публикации данных, предотвращение ненужного дублирования исследований и помощь общественности и потенциальным участникам в том, чтобы быть в курсе всех текущих исследований.
Существует ряд общедоступных реестров клинических испытаний, два из которых чаще всего упоминаются в реестрах Международной платформы реестров клинических испытаний ВОЗ (ICTRP) и ClinicalTrials.gov. Эти реестры являются некоммерческими, доступны для общественности бесплатно и имеют механизмы, обеспечивающие достоверность зарегистрированных данных.
В некоторых странах есть реестры испытаний, специфичные для их региона. Например, в Австралии у нас есть Реестр клинических испытаний Австралии и Новой Зеландии (ANZCTR), который частично финансируется правительством Австралии. Все клинические испытания должны быть зарегистрированы в ANZCTR после утверждения этики, при этом ANZCTR предоставляет данные в ICTRP.
Регистрация клинического протокола в настоящее время является основным требованием журналов перед публикацией. Вам потребуется предоставить доказательства того, что исследование было зарегистрировано до включения первого пациента в ваше исследование. Лучший способ сделать это — указать регистрационный номер вашей пробной версии в вашей рукописи. Регистрационный номер также будет опубликован, как правило, в реферате или основной части рукописи.
Международный комитет редакторов медицинских журналов (ICMJE) предоставляет исчерпывающую информацию о требованиях к регистрации испытаний и обмену данными перед публикацией вашего исследования.
Совет: при планировании протокола исследования потратьте некоторое время на просмотр реестров испытаний, чтобы получить представление о том, какую информацию вам необходимо зарегистрировать. Это поможет вам соответствующим образом спланировать свое исследование. Кроме того, если у вас есть представление о том, в какой журнал вы хотели бы отправить свое исследование, ознакомьтесь с его требованиями для регистрации исследования. Например, вы можете проверить, есть ли у журнала предпочтения относительно того, какие протоколы исследований реестра испытаний должны быть зарегистрированы.
Как показывает даже этот относительно короткий и ни в коем случае не исчерпывающий список, при написании протокола клинического исследования необходимо учитывать множество моментов.
Хорошей отправной точкой является просмотр сети ЭКВАТОР. Это зонтичная организация, которая предоставляет ссылки и информационные руководства по всем аспектам и стилям клинических исследований.

 И запрос, и ответ должны соответствовать структуре SOAP.
И запрос, и ответ должны соответствовать структуре SOAP.
 Это предпочтительный вариант, если вы еще не начали писать свою рукопись.
Это предпочтительный вариант, если вы еще не начали писать свою рукопись.